Último día de clase de Recursos en Didáctica de Física y Química! ¿Y qué significa eso?
¡DÍA DE LA FIESTA DE EXPERIMENTOS!
Mi compañera Celia y yo llevamos días pensando en cómo sorprender a nuestros compañeros. No está nada fácil, pues todos los experimentos están inventados, o sea que después de un pequeño hurto de experimento y una búsqueda exhausta de bibliografía y distintas webs, hemos decidido estudiar la conductividad de diferentes disoluciones en función del tipo de enlace (iónico o covalente). Es un contenido impartido en 4ºESO y creemos que es una buena idea porque se trata de un tema bastante abstracto (al menos a mí sí que me hubiera gustado que me lo hubieran enseñado como hemos explicado nosotras en clase).
Antes de enseñaros el procedimiento experimental que hemos grabado Celia y yo además de nuestro fabuloso paisaje de aprendizaje (que sé que es lo que más os gusta), os daré unas breves pinceladas acerca de la conductividad en compuestos iónicos y los compuestos covalentes moleculares.
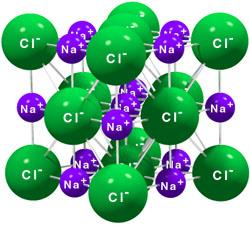
De manera general, existen una serie de propiedades como los puntos de fusión y ebullición, la solubilidad o la conductividad entre otras, que se pueden predecir a partir de la dureza del enlace químico que mantiene unido el compuesto. En el caso de los iónicos, sabemos que son redes formadas por muchísimos iones, cationes y aniones, que se atraen electrostáticamente. La atracción electrostática es un enlace de tipo no direccional y bastante fuerte, lo que explicaría lo difícil que es desprender los aniones de los cationes y que sean sólidos a temperatura ambiente con PE y PF elevados.
Cuando un cristal iónico como la sal común (NaCl) se encuentra en estado sólido, no conduce la electricidad, pues los iones se encuentran en posiciones fijas dentro de la red y no hay cargas libres. Sin embargo cuando ese cristal de sal lo disolvemos en agua (los compuestos iónicos son solubles en disolventes polares) sí que son conductores. ¿Y por qué?
Gracias a la polaridad que presenta el agua provocada por la diferencia de electronegatividad entre el átomo de oxígeno y los dos de hidrógeno, nos encontraremos dos zonas con cargas distintas en la propia molécula. Esta polaridad permite atraer por el lado correspondiente a cada uno de los iones de la red pudiendo arrancarlos. Este proceso se conoce como solvatación y en la disolución tendríamos las llamadas esferas de solvatación, cationes y aniones libres rodeados de moléculas de agua. De esta forma, al conectar dicha disolución a un circuito, los cationes migrarán hacia el polo negativo de la pila y los aniones hacia el positivo generándose corriente eléctrica.
En cuanto a los compuestos covalentes moleculares, no son conductores, no hay cargas libres ya que sus compuestos son neutros y los electrones están fuertemente localizados y atraídos por los dos núcleos de los átomos que los comparten. Tenemos moléculas independientes y en estas circunstancias, es muy difícil que haya una libertad de movimiento para los electrones. Únicamente conducirán la corriente las sustancias covalentes moleculares polares siempre y cuando al disolverlos se disocien en electrolitos como ocurre con el cloruro de hidrógeno.
¡Ahora sí que sí! Ha llegado la hora de enseñaros un trocito de nuestro laboratorio casero en el siguiente vídeo y nuestro genially.
Por cierto, ¿os imagináis hacer un cohete con una bolsa de té? Ayer mi compañera María me enseñó cómo hacerlo. No me lo estoy inventando, mirad: VID-20210127-WA0040
¿Y un cohete con una botella, un poco de alcohol de quemar y una llama y que salga despedido a gran velocidad? Mirad el que construyeron mis compañeros Edu y Miguel: VID-20210127-WA0038 (2)
¡También hubo competición de ver qué llegaba antes a la superficie, si un huevo, una canica, una aceituna o una pesa! Los responsables del fracaso de la apuesta en mi cabeza son Jorge y Celia.
¡Ah! ¿Habéis probado a apagar una vela sin soplar? ¡Porque Jorge hoy ha hecho magia de la buena!
¿Y habéis tenido la ocasión de ver figuras de Chladni en directo? ¡Pues yo sí! Gracias a mis queridos Marco y José.
Ayer he vuelto a reencontrarme con la niña que llevo dentro, a recordar por qué elegí estudiar ciencias. He disfrutado de todos y cada uno de los experimentos que mis compañeros han preparado, he estado ilusionada y emocionada de principio a fin de la clase y espero que algún día pueda lograr motivar al menos la mitad de bien a mis alumnos de lo que nuestra profesora María Jesús ha conseguido con nosotros durante estas semanas.
Continuará…





Aún no hay comentarios.